Zdalna Przychodnia » Baza wiedzy » Choroby układu nerwowego » Tętniak mózgu
WSTĘP
W artykule tym omówione zostaną epidemiologię i patogenezę tętniaków tętnic wewnątrzczaszkowych oraz postępowanie w przypadku tętniaków niepękniętych.
EPIDEMIOLOGIA
Częstość występowania wewnątrzczaszkowych tętniaków workowatych na podstawie badań radiograficznych i autopsyjnych ocenia się na 3,2 procent w populacji bez chorób współistniejących, średnim wieku 50 lat i stosunku płci 1:1 [1,2,3]. Spośród pacjentów z tętniakami mózgu 20 do 30 procent ma tętniaki mnogie [4]. Krwotok podpajęczynówkowy (subarachnoid hemorrhage – SAH) spowodowany pęknięciem tętniaka mózgu występuje z częstością od 6 do 16 na 100 000 mieszkańców [5]. W Polsce przekłada się to na około 4 000 chorych rocznie. W związku z tym większość tętniaków, zwłaszcza małych, nie ulega pęknięciu.
Uważa się, że pęknięcie tętniaka mózgu odpowiada za 0,4 do 0,6 procent wszystkich zgonów. Około 10 procent pacjentów umiera przed dotarciem do szpitala, a tylko jedna trzecia ma „dobry wynik” po leczeniu.
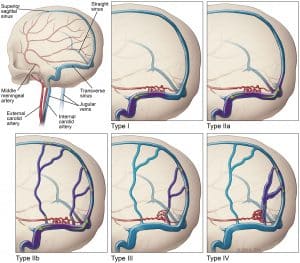
Większość tętniaków wewnątrzczaszkowych (około 85 procent) znajduje się w krążeniu przednim, głównie na kręgu Willisa. Częstym miejscem występowania jest połączenie tętnicy łączącej przedniej z tętnicą przednią mózgu, połączenie tętnicy łączącej tylnej z tętnicą szyjną wewnętrzną oraz rozwidlenie tętnicy środkowej mózgu. Lokalizacje tętniaków mózgu w krążeniu tylnym często obejmują szczyt tętnicy podstawnej, połączenie tętnicy podstawnej z tętnicą móżdżkową górną lub tętnicą móżdżkową przednią dolną oraz połączenie tętnicy kręgowej z tętnicą móżdżkową tylną dolną.
Tętniaki mózgu występują częściej u kobiet – w populacjach starszych niż 50 lat zwiększona częstość występowania u kobiet może zbliżać się do stosunku 2:1 lub większego.
CZYNNIKI RYZYKA POWSTAWANIA TĘTNIAKÓW MÓZGU
Czynniki genetyczne
Za rolą czynników genetycznych w patogenezie powstawania tętniaków wewnątrzczaszkowych przemawiają badania, w których stwierdzono zwiększone ryzyko występowania tętniaków mózgu u pacjentów z niektórymi znanymi zespołami dziedzicznymi oraz występowanie tętniaków w rodzinach. Przeglądy systematyczne i metaanalizay potwierdziły znaczący udział czynników genetycznych w powstawaniu tętniaków wewnątrzczaszkowych, które obejmują wiele ścieżek patofizjologicznych.
Zespoły dziedziczne
Znany zespół dziedziczny jest często obecny w przypadku rozpoznania tętniaków u więcej niż jednego członka rodziny. Do dziedzicznych zaburzeń związanych z występowaniem tętniaka mózgu należą:
- Choroby tkanki łącznej, takie jak zespół Ehlersa-Danlosa i pseudoxanthoma elasticum (kępki żółte rzekome), są związane z występowaniem tętniaków wewnątrzczaszkowych. Mechanizm, w którym choroby tkanki łącznej predysponują do powstawania tętniaków mózgu, wiąże się prawdopodobnie z wrodzonym osłabieniem ściany tętnicy narażonej na nielaminarny sposób przepływu krwi, która jest następnie narażona na naprężenia. Tworzenie się tętniaków w glikokortykosteroidowym hiperaldosteronizmie może wynikać częściowo z wrodzonego nadciśnienia tętniczego we wczesnym okresie rozwoju naczyń mózgowych. Współistniejące nadciśnienie tętnicze może również przyczyniać się do tego w wielotorbielowatej chorobie nerek (PKD), chociaż dokładny mechanizm jest niejasny. Nie ma pewności, czy pacjenci z tymi zaburzeniami powinni być poddawani rutynowym badaniom przesiewowym w kierunku tętniaka wewnątrzczaszkowego. (Patrz „Badania przesiewowe w kierunku tętniaka wewnątrzczaszkowego”, rozdział „Inne zaburzenia dziedziczne”).
- Autosomalnie dominująca wielotorbielowatość nerek (PKD) wiąże się z 6,9-krotnie wyższym ryzykiem wystąpienia tętniaka wewnątrzczaszkowego [7]. Autosomalne recesywne PKD może być również czynnikiem ryzyka [16]. Rola badań przesiewowych w kierunku tętniaków u pacjentów z PKD została omówiona oddzielnie. Badania przesiewowe u tych pacjentów opisano oddzielnie. (Patrz „Badania przesiewowe w kierunku tętniaka wewnątrzczaszkowego”, część „Inne zaburzenia dziedziczne”).
- Zespół moyamoya jest również związany ze zwiększoną częstością występowania tętniaków wewnątrzczaszkowych. Chociaż większość przypadków zespołu moyamoya występuje sporadycznie, u podłoża choroby leży prawdopodobnie podatność genetyczna, a znane jest rodzinne występowanie.
Tętniaki mózgu – występowanie rodzinne
- Członkowie rodzin pacjentów z tętniakami wewnątrzczaszkowymi są narażeni na zwiększone ryzyko wystąpienia tętniaka, nawet w przypadku braku znanego zespołu dziedzicznego. W jednym z badań, na przykład, skorygowana o wiek częstość występowania przypadkowych tętniaków u krewnych pierwszego stopnia pacjentów z tętniakiem wynosiła 9 procent, liczba znacznie wyższa niż w populacji ogólnej [6]. Tylko niewielki odsetek tych rodzin miał identyfikowalny zespół dziedziczny, o którym wiadomo, że jest związany z tętniakami mózgu. W drugim raporcie dotyczącym pacjentów z głównie sporadycznym krwotokiem podpajęczynówkowym (SAH), tętniaki wewnątrzczaszkowe stwierdzono u 4 procent krewnych pierwszego stopnia (około dwa razy więcej niż w populacji ogólnej). W innych badaniach oceniono, że rodzinne występowanie tętniaka lub SAH wiąże się z 3,6-krotnie większym ryzykiem [7].
- Sposób dziedziczenia nie jest do końca poznany i jest różny, z autosomalnym dominującym, recesywnym. Tętniaki mózgowe występujące rodzinnie zostały powiązane z wieloma loci chromosomalnymi.
- Tętniaki mózgu występujące rodzinne mają tendencję do pękania przy mniejszych rozmiarach i w młodszym wieku niż tętniaki sporadyczne [17,27,28]. U rodzeństwa często dochodzi do pęknięcia w tej samej dekadzie życia [27]. Tętniaki mają tendencję do występowania w podobnych miejscach w rodzinach, co sugeruje, że specyficzna podatność anatomiczna może być dziedziczona [29].
Tętniaki mózgu – inne czynniki ryzyka
- Palenie papierosów – palacze papierosów mają istotnie zwiększone ryzyko wystąpienia SAH w porównaniu z populacją kontrolną; ryzyko względne dla mężczyzn i kobiet wynosiło odpowiednio 3,0 i 4,7, a ryzyko wzrastało wraz z liczbą wypalanych papierosów. U osób, które paliły papierosy i jednocześnie miały nadciśnienie tętnicze, stwierdzono prawie 15-krotny wzrost ryzyka wystąpienia krwotoku podpajęczynówkowego w porównaniu z osobami niepalącymi z normalnym ciśnieniem tętniczym [8]. Mechanizm, w którym palenie papierosów predysponuje do powstawania tętniaków, może polegać na zmniejszeniu skuteczności działania alfa-1 antytrypsyny, ważnego inhibitora proteaz, takich jak elastaza. Wsparcie dla tej hipotezy pochodzi z badań, które sugerują, że pacjenci z niedoborem alfa-1 antytrypsyny są narażeni na zwiększone ryzyko powstania tętniaka [9].
- Nadciśnienie tętnicze – związek między nadciśnieniem tętniczym a powstawaniem i pękaniem tętniaków jest kontrowersyjny, chociaż bilans dowodów wskazuje, że nadciśnienie jest czynnikiem ryzyka [10]. W jednym z opublikowanych badań porównano 113 pacjentów z SAH i angiograficznie zweryfikowanymi tętniakami z 63 pacjentami z SAH bez tętniaka [11]. Ciśnienie krwi większe niż 160/95 występowało u 62 procent pacjentów z tętniakami w porównaniu z 37 procentami bez nich.
- Niedobór estrogenów – tętniaki mózgu występują częściej u kobiet.m Niedobór estrogenów w okresie menopauzy powoduje zmniejszenie zawartości kolagenu w tkankach, który może przyczyniać się do rozwoju tętniaków u kobiet po menopauzie, analogicznie do sytuacji u pacjentów z chorobami tkanki łącznej. W jednym z badań kobiety przedmenopauzalne bez wywiadu dotyczącego palenia tytoniu lub nadciśnienia tętniczego miały zmniejszone ryzyko wystąpienia krwotoku podpajęczynówkowego w porównaniu z dopasowanymi wiekowo kobietami po menopauzie. Ponadto stosowanie estrogenowej terapii zastępczej było związane ze zmniejszonym ryzykiem SAH u kobiet po menopauzie.
- Koarktacja aorty – pacjenci z koarktacją aorty są narażeni na zwiększone ryzyko powstania tętniaka, może to wynikać z wtórnego nadciśnienia lub ze wspólnych morfologicznych lub genetycznych czynników ryzyka.
Tętniak mózgu – patogeneza
Tętniaki workowate naczyń mózgowych są odpowiedzialne za większość krwotoków podpajęczynówkowych (SAH), chociaż u wybranych pacjentów powstają również tętniaki wrzecionowate i mykotyczne.
- Tętniaki workowate są cienkościennymi wypukłościami ścian tętnic wewnątrzczaszkowych, które składają się z bardzo cienkiej lub nieobecnej błony środkowej oraz nieobecnej lub mocno pofragmentowanej wewnętrznej błony sprężystej.
- Tętniaki wrzecionowate polegają na powiększeniu lub poszerzeniu całego obwodu naczynia, które może częściowo powstać w wyniku miażdżycy.
- Tętniaki mykotyczne powstają z lokalnego zapalenia ściany tętnicy w wyniku zatorowości septycznej w przebiegu infekcyjnego zapalenia wsierdzia.
Workowate tętniaki mózgu są zmianami nabytymi, a nie wrodzonymi. Patogeneza powstawania tętniaków workowatych jest wieloczynnikowa [12]. Stres hemodynamiczny powoduje nadmierne zużycie i rozpad wewnętrznej błony sprężystej. Turbulentny przepływ krwi wytwarza drgania, które mogą pokrywać się z częstotliwością rezonansową ściany naczynia, co skutkuje zmęczeniem strukturalnym. Pacjenci z hiperdynamicznymi wzorcami przepływu w wyniku anomalii budowy naczyń lub innych stanów wysokiego przepływu są predysponowani do przyspieszonych zmian degeneracyjnych w ścianie naczynia i późniejszego rozwoju tętniaka. Nadciśnienie tętnicze, palenie papierosów i choroby tkanki łącznej prawdopodobnie odgrywają w tym procesie raczej rolę pomocniczą niż przyczynową. Istnieją również doniesienia, że zapalenie odgrywa rolę w patogenezie i wzroście tętniaków wewnątrzczaszkowych [13].
Wzrost i pęknięcie tętniaka wewnątrzczaszkowego
Uważa się, że większość tętniaków mózgu rozwija się w ciągu krótkiego okresu: godzin, dni lub tygodni, osiągając wielkość, na którą pozwalają granice elastyczności ściany tętniaka; w tym momencie tętniak albo pęka, albo ulega stabilizacji i stwardnieniu [14]. Tętniaki, które nie pękną, zyskują znaczną wytrzymałość na rozciąganie dzięki kompensacyjnemu utwardzeniu z wytworzeniem kolagenu. Dlatego też prawdopodobieństwo pęknięcia maleje, jeśli wielkość tętniaka nie jest dość duża w momencie początkowej stabilizacji. Tętniaki o wielkości 1 cm lub większe w momencie początkowej stabilizacji są znacznie bardziej narażone na późniejszy wzrost i pęknięcie, ponieważ naprężenie w ścianie wzrasta z kwadratem średnicy (prawo Laplace’a).
Uważa się, że ta teoria wzrostu i pęknięcia tętniaka wyjaśnia pozorną rozbieżność między danymi, które wskazują na niski odsetek pęknięć tętniaków o średnicy 7-10 mm i mniejszych [15], a obserwacją, że u znacznego odsetka pacjentów z krwotokiem podpajęczynówkowym doszło do pęknięcia tętniaków o średnicy mniejszej niż 10 mm, a u większości z nich średnica jest mniejsza niż 7 mm [16]. Tak więc krytyczny dla pęknięcia tętniaka rozmiar jest mniejszy w przypadku tętniaków, które pękają wkrótce po utworzeniu, co wydaje się być prawdą w przypadku zdecydowanej większości małych tętniaków.
OBJAWY KLINICZNE TĘTNIAKÓW MÓZGU
Większość tętniaków wewnątrzczaszkowych jest bezobjawowa, o ile nie pękną, dlatego zwykle wykrywa się je przypadkowo lub gdy pacjent zgłasza się z krwotokiem podpajęczynówkowym (SAH).
Niektóre niepęknięte tętniaki mózgu mogą stać się objawowe. Objawy obejmują:
- ból głowy (który może być silny i porównywalny z bólem głowy w SAH),
- utratę ostrości wzroku,
- neuropatie czaszkowe (szczególnie porażenie trzeciego nerwu),
- dysfunkcję dróg piramidowych i ból twarzy; uważa się, że są one spowodowane efektem masowym tętniaka.
Niedokrwienie może wystąpić w wyniku zatorów pochodzących z wnętrza tętniaka.
Leczenie tętniaka może prowadzić do ustąpienia objawów.
DIAGNOSTYKA TĘTNIAKÓW MÓZGU
Większość tętniaków mózgu objawia się krwotokiem podpajęczynówkowym (SAH) lub jest wykrywana przypadkowo lub podczas badań przesiewowych.
Ponieważ objawowe niepęknięte tętniaki są rzadkie, istnieje niewiele danych na temat najlepszej strategii diagnostycznej w obecności objawów, które mogą być spowodowane przez tętniaka. Jednym z wyjątków jest sytuacja kliniczna, w której dochodzi do porażenia nerwu trzeciego bez oszczędzania źrenicy, którego ocena została omówiona oddzielnie.
Angiografia rezonansu magnetycznego (MRA) i angiografia tomografii komputerowej (CTA) są dobrymi wiarygodnymi badaniami służącymi do wykrywania tętniaków o wielkości 3 mm lub większych. Najbardziej dokładną metodą obrazowania naczyń mózgowych jest arteriografia mózgowa – jednak badanie to jest inwazyjne i przeprowadzane jest poprzez nakłucie tętnicy i wprowadzenie cewnika do tętnic dogłowowych. Arteriografia mózgowa służy do dokładnej oceny morfologii tętniaka wykrytego podczas innych badań obrazowych, do planowania zabiegów wewnątrznaczyniowych emboqizacji tętniaków mózgowych oraz do kontroli pacjentów po zabiegach embolizacji.
CZYNNIKI RYZYKA PĘKNIĘCIA TĘTNIAKA MÓZGU
Wnioski dotyczące czynników ryzyka pęknięcia tętniaków mózgu wyciągane są na podstawie badań prospektywnych, w których przez wiele lat obserwowani byli pacjenci z tętniakami mózgu. Do największych tego typu badań należą:
- International Study of Unruptured Intracranial Aneurysms (ISUIA), w którym prospektywnie oceniono 1692 pacjentów z 2686 niepękniętymi, (6544 pacjento-lat) w Stanach Zjednoczonych, Kanadzie i Europie [17];
- Unruptured Cerebral Aneurysms Study (UCAS), japońskie badanie, w którym obserwowano 6697 tętniaków u 5720 pacjentów (11 660 tętniako-lat) [18]. W obu tych badaniach zauważono, że rozmiar i lokalizacja tętniaka były związane z ryzykiem pęknięcia.
Skala PHASES, opracowana na podstawie zbiorczej analizy sześciu tego typu prospektywnych badań kohortowych, uwzględnia wiek, nadciśnienie tętnicze, maksymalną średnicę tętniaka, wcześniejszy krwotok podpajęczynówkowy (SAH) oraz lokalizację tętniaka jako główne czynniki predykcyjne pęknięcia tętniaka mózgu i stanowi użyteczne podsumowanie dla indywidualizacji decyzji dotyczących postępowania.
Wielkość tętniaka a ryzyko pęknięcia
Badania ISUIA i UCAS potwierdziły wyniki wcześniejszych badań wskazujących, że ryzyko pęknięcia tętniaka były niższe w przypadku mniejszych tętniaków. Punktem odcięcia wielkości w obu badaniach dla zdefiniowania niskiego ryzyka pęknięcia było 7 mm [54,67]. Wraz ze wzrostem rozmiaru powyżej 7 mm ryzyko wystąpienia krwowotku podpajęczynówkowego spowodowanego pęknięciem tętniaka odpowiednio wzrasta.
W badaniu ISUIA, w przypadku tętniaków krążenia przedniego, pięcioletni wskaźnik ryzyka pęknięcia dla tętniaków o wymiarach:
- od 7 do 12 mm wynosił 2,6 procent;
- od 13 do 24 mm -wynosił 14,5 procent;
- >25 mm – 40 procent.
Inne prospektywne badanie obserwowało 374 pacjentów z 448 tętniakami o wielkości <5 mm. Średni roczny odsetek pęknięcia wynosił 0,54 procent ogólnie, 0,34 procent dla pojedynczych tętniaków i 0,95 procent dla tętniaków mnogich. W tej grupie ryzyko pęknięcia tętniaka było również nieco wyższe u osób w wieku <50 lat i u osób z tętniakami o wielkości >4 mm [19].
Wzrost wielkości tętniaka a ryzyko jego pęknięcia
Wzrost wielkości tętniaka jest bardziej prawdopodobny w przypadku większych niż mniejszych tętniaków. Wśród 165 pacjentów z 191 niepękniętymi tętniakami częstość powiększania się w ciągu 47 miesięcy wynosiła 7, 25 i 83% odpowiednio dla tętniaków <8 mm, 8 do 12 mm i >13 mm [20]. W jednym z badań stwierdzono również, że tętniaki tętnic szyjnych wewnętrznych i tętnicy podstawnej były bardziej narażone na wzrost niż te zlokalizowane w innych regionach [21].
Uważa się, że tętniaki, które zwiększają swój rozmiar, są obarczone wysokim ryzykiem pęknięcia i że nieleczone tętniaki powinny być monitorowane pod kątem wzrostu.
W jednym badaniu obserwowano 165 pacjentów z 258 niepękniętymi tętniakami, u których wykonano seryjną angiografię tomografii komputerowej (CTA) . Zaobserwowano, że osiemnaście procent tętniaków powiększa się i wiąże się to z wyższym ryzykiem ich pęknięcia w porównaniu do tych, które nie rosły (2,4% vs 0,2% rocznie)[22].
Lokalizacja a ryzyko pęknięcia tętniaka mózgu
Zarówno w badaniu ISUIA i UCAS, jak i w innych badaniach stwierdzono, że ryzyko pęknięcia tętniaka różni się w zależności od jego lokalizacji.
W badaniu ISUIA trzy grupy lokalizacji tętniaka były związane z różnymi wskaźnikami ryzyka pęknięcia:
- Tętniaki w obrębie jamistego odcinka tętnicy szyjnej wewnętrznej (ICA) miały najniższe ryzyko pęknięcia;
- Tętniaki tętnic krążenia przedniego: tętnicy szyjnej wewnętrznej, tętnicy środkowej, tętnicy łączącej przedniej, miały pośrednie ryzyko pęknięcia;
- Tętniaki tylnego krążenia: tętnic kręgowych, tętnicy podstawnej, tętnic łączących tylnych i tylnych miały największe ryzyko pęknięcia;
Wcześniejszy krwotok z pękniętego tętniaka a ryzyko kolejnego pęknięcia tętniaka
Jeśli u danej osoby wystąpił wcześniej krwotok podpajęczynówkowy(SAH) z pękniętego tętniaka, ryzyko pęknięcia oddzielnego tętniaka jest prawdopodobnie większe niż gdyby osoba nie miała takiego wywiadu. W badaniach niepęknięte tętniaki o średnicy mniejszej niż 7 mm u pacjentów z tętniakowatym SAH w wywiadzie pękały z częstością 0,5% rocznie w porównaniu z 0,1% rocznie u osób bez wcześniejszego tętniakowatego SAH.
Postępowanie w razie wykrycia tętniaka mózgu
Postępowanie w przypadku niepękniętych tętniaków wewnątrzczaszkowych nie jest jednoznaczne – decyzje dotyczące leczenia muszą uwzględniać naturalną historię przebiegu choroby, ryzyko interwencji oraz preferencje pacjenta.
Ryzyko interwencji
W badaniach obserwacyjnych, w których porównywano ryzyko związane z zabiegiem chirurgicznego klipsowania tętniaka mózgu i wewnątrznaczyniową embolizacją tętniaków mózgu, stwierdzono mniejszy odsetek niekorzystnych wyników u pacjentów leczonych metodą wewnątrznaczyniową. W badaniu International Study of Unruptured Intracranial Aneurysms (ISUIA) wskaźniki złego wyniku neurologicznego w ciągu jednego roku wynosiły 12,6 i 9,8 procent dla osób leczonych chirurgicznie i wewnątrznaczyniowo [23]. W innym badaniu kohortowym zabieg wewnątrznaczyniowej emboqizacji tętniaka wiązał się z mniejszą śmiertelnością (0,6 versus 1,6 procent) i mniejszym odsetkiem powikłań (4,3 versus 9,0 procent) [24].
Korzyści z interwencji
Badacze z ISUIA stwierdzili, że u pacjentów bez wcześniejszego krwotoku podpajęczynówkowego (SAH) jest mało prawdopodobne, aby jakakolwiek terapia była w stanie poprawić historię naturalną nieleczonych tętniaków mniejszych niż 7 mm.
Badacze wskazują również na konkretne grupy z ich danych, które wydają się mieć największe korzyści z interwencji, takich jak otwarta operacja dla pacjentów młodszych niż 50 lat z tętniakami tętnicy łączącej tylnej, które są 7 do 24 mm. Chociaż uwzględnienie tych danych dotyczących podgrup może być właściwe przy formułowaniu zaleceń dla poszczególnych pacjentów, należy pamiętać, że takie analizy podgrup są podatne na problemy statystyczne i wymagają prospektywnego potwierdzenia.
Wskazania do interwencji
Dostępne badania podkreślają konieczność indywidualnego rozpatrywania każdego przypadku, z uwzględnieniem takich czynników jak współistniejące choroby, wiek pacjenta, wielkość i lokalizacja tętniaka oraz ryzyko związane z leczeniem. Suma tych danych przemawia za przewidywanym postępowaniem w przypadku bardzo małych tętniaków workowatych, zwłaszcza gdy tętniaki takie są zlokalizowane w krążeniu przednim lub gdy są wykrywane u starszych pacjentów.
Grupa zadaniowa Stroke Council of the American Heart Association opublikowała zalecenia dotyczące postępowania u pacjentów z niepękniętym tętniakiem wewnątrzczaszkowym:
Leczenie małych, incydentalnych, wewnątrzjamistych tętniaków tętnicy szyjnej wewnętrznej zasadniczo nie jest wskazane. W przypadku dużych objawowych tętniaków wewnątrzjamistych decyzje dotyczące leczenia powinny być zindywidualizowane na podstawie wieku pacjenta, nasilenia i progresji objawów oraz alternatywnych metod leczenia. Większe ryzyko leczenia i krótsza oczekiwana długość życia u osób starszych muszą być brane pod uwagę u wszystkich pacjentów i przemawiają za obserwacją u starszych pacjentów z bezobjawowymi tętniakami.
Współistniejące lub pozostałe tętniaki wszystkich rozmiarów u pacjentów z SAH spowodowanym innym leczonym tętniakiem uzasadniają rozważenie leczenia. Tętniaki zlokalizowane w koniuszku tętnicy podstawnej wiążą się ze stosunkowo dużym ryzykiem pęknięcia. Decyzje dotyczące leczenia muszą uwzględniać wiek pacjenta, istniejący stan medyczny i neurologiczny oraz względne ryzyko naprawy. Jeśli podjęta zostanie decyzja o obserwacji, należy rozważyć okresową ponowną ocenę za pomocą angiografii tomografii komputerowej (CTA)/angiografii rezonansu magnetycznego (MRA) lub angiografii z selektywnym kontrastem, z poszukiwaniem zmian w rozmiarze tętniaka, chociaż w celu optymalizacji wiarygodności tych pomiarów konieczne będzie zwrócenie uwagi na czynniki techniczne.
Biorąc pod uwagę pozornie niskie ryzyko krwotoku z przypadkowych, małych (<7 mm) tętniaków u pacjentów bez wcześniejszego SAH, zasadniczo zaleca się raczej obserwację niż interwencję. Szczególną uwagę na leczenie należy jednak zwrócić na młodych (<50 lat) pacjentów z tej grupy.
Bezobjawowe tętniaki o średnicy ≥7 do 10 mm uzasadniają zdecydowane rozważenie leczenia, z uwzględnieniem wieku pacjenta, istniejących schorzeń ogólnych i neurologicznych oraz względnego ryzyka związanego z leczeniem
Wybór procedury
W badaniach klinicznych, prowadzonych zwykle w ośrodkach o dużej liczbie przypadków, techniki wewnątrznaczyniowe wydają się być związane z mniejszą zachorowalnością i śmiertelnością niż chirurgiczne klipsowanie i odgrywają coraz większą rolę w leczeniu niepękniętych tętniaków.
Nowe technologie, takie jak przekierowanie przepływu, mogą zwiększyć bezpieczeństwo leczenia wewnątrznaczyniowego i umożliwić poddanie leczeniu tętniaków, które wcześniej uważano za niedostępne lub trudne technologicznie do takiego leczenia [97].
Sytuacje szczególne
Bywa, że tętniak wewnątrzczaszkowy jest związany z wewnątrzczaszkową malformacją tętniczo-żylną (AVM). Tętniaki te są bardziej narażone na wzrost i pęknięcie niż inne tętniaki. Dlatego zaleca się naprawę tętniaka przed leczeniem AVM.
Stosowanie terapii przeciwzakrzepowej – Pacjenci z tętniakami wewnątrzczaszkowymi mogą wymagać terapii przeciwzakrzepowej w związku z leczeniem innych schorzeń, takich jak migotanie przedsionków. Dostępne dane są ograniczone, nieco sprzeczne i niewystarczające, aby stwierdzić, czy terapia przeciwzakrzepowa (np. warfaryna) lub przeciwpłytkowa zwiększa ryzyko pęknięcia tętniaka. Wydaje się, że terapia antykoagulacyjna zwiększa ciężkość pęknięcia w przypadku jego wystąpienia.
Obserwacja tętniaków mózgu
W przypadku pacjentów z niepękniętymi tętniakami śródczaszkowymi nieleczonych chirurgicznie lub metodami endowaskularnymi zaleca się ich regularne monitorowanie:
Stabilne tętniaki wewnątrzczaszkowe powinny być monitorowane za pomocą agio-TK lub angio-MR co roku przez dwa do trzech lat, a następnie co dwa do pięciu lat, jeśli tętniak jest stabilny klinicznie i radiologicznie.
Rozsądnym jest wykonanie pierwszego badania obrazowego nowo wykrytych małych tętniaków po sześciu miesiącach, ponieważ istnieją dowody na to, że nowo powstałe małe tętniaki mogą być bardziej narażone na pęknięcie niż starsze, bardziej stabilne tętniaki.
Pacjenci nie poddani interwencji powinni być poinstruowani, aby unikali palenia tytoniu, nadmiernego spożywania alkoholu, leków pobudzających, narkotyków oraz nadmiernego wysiłku i manewrów Valsalvy.
Piśmiennictwo
- Unruptured intracranial aneurysms: development, rupture and preventive management. Etminan N, Rinkel GJ ; Nat Rev Neurol. 2016;12(12):699. Epub 2016 Nov 3.
- Incidental findings on brain MRI in the general population. Vernooij MW, Ikram MA, Tanghe HL, Vincent AJ, Hofman A, Krestin GP, Niessen WJ, Breteler MM, van der Lugt A – N Engl J Med. 2007;357(18):1821.
- Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: a systematic review and meta-analysis. Vlak MH, Algra A, Brandenburg R, Rinkel GJ – Lancet Neurol. 2011;10(7):626.
- ANEURYSMS AND ANATOMICAL VARIATION OF CEREBRAL ARTERIES. STEHBENS WE; Arch Pathol. 1963;75:45.
- Epidemiology of subarachnoid hemorrhage in Finland from 1983 to 1985. Sarti C, Tuomilehto J, Salomaa V, Sivenius J, Kaarsalo E, Narva EV, Salmi K, Torppa J ; Stroke. 1991;22(7):848.
- Familial intracranial aneurysms. Ronkainen A, Hernesniemi J, Puranen M, Niemitukia L, Vanninen R, Ryynänen M, Kuivaniemi H, Tromp G; Lancet. 1997;349(9049):380.
- Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: a systematic review and meta-analysis. Vlak MH, Algra A, Brandenburg R, Rinkel GJ; Lancet Neurol. 2011;10(7):626.
- Cigarette smoking, hypertension and the risk of subarachnoid hemorrhage: a population-based case-control study. Bonita R; Stroke. 1986;17(5):831.
- Alpha-1-antitrypsin deficiency in aneurysmal disease. St Jean P, Hart B, Webster M, Steed D, Adamson J, Powell J, Ferrell R; Hum Hered. 1996;46(2):92.
- Independent risk factors for intracranial aneurysms and their joint effect: a case-control study. Vlak MH, Rinkel GJ, Greebe P, Algra A; Stroke. 2013 Apr;44(4):984-7. Epub 2013 Feb 19.
- Direct evidence of hypertension and the possible role of post-menopause oestrogen deficiency in the pathogenesis of berry aneurysms. Stober T, Sen S, Anstätt T, Freier G, Schimrigk K – J Neurol. 1985;232(2):67.
- Pathogenesis, natural history, and treatment of unruptured intracranial aneurysms. Wiebers DO, Piepgras DG, Meyer FB, Kallmes DF, Meissner I, Atkinson JL, Link MJ, Brown RD Jr; Mayo Clin Proc. 2004;79(12):1572.
- The role of oxidative stress in cerebral aneurysm formation and rupture. Starke RM, Chalouhi N, Ali MS, Jabbour PM, Tjoumakaris SI, Gonzalez LF, Rosenwasser RH, Koch WJ, Dumont AS; Curr Neurovasc Res. 2013;10(3):247.
- Pathogenesis, natural history, and treatment of unruptured intracranial aneurysms. Wiebers DO, Piepgras DG, Meyer FB, Kallmes DF, Meissner I, Atkinson JL, Link MJ, Brown RD Jr ; Mayo Clin Proc. 2004;79(12):1572.
- The significance of unruptured intracranial saccular aneurysms. Wiebers DO, Whisnant JP, Sundt TM Jr, O’Fallon WM; J Neurosurg. 1987;66(1):23.
- Unruptured intracranial aneurysms: prospective data have arrived. White PM, Wardlaw J ; Lancet. 2003;362(9378):90.
- Unruptured intracranial aneurysms: natural history, clinical outcome, and risks of surgical and endovascular treatment. Wiebers DO, Whisnant JP, Huston J 3rd, Meissner I, Brown RD Jr, Piepgras DG, Forbes GS, Thielen K, Nichols D, O’Fallon WM, Peacock J, Jaeger L, Kassell NF, Kongable-Beckman GL, Torner JC, International Study of Unruptured Intracranial Aneurysms Investigators; Lancet. 2003;362(9378):103.
- The natural course of unruptured cerebral aneurysms in a Japanese cohort. UCAS Japan Investigators, Morita A, Kirino T, Hashi K, Aoki N, Fukuhara S, Hashimoto N, Nakayama T, Sakai M, Teramoto A, Tominari S, Yoshimoto T ; N Engl J Med. 2012 Jun;366(26):2474-82.
- Small unruptured intracranial aneurysm verification study: SUAVe study, Japan. Sonobe M, Yamazaki T, Yonekura M, Kikuchi H; Stroke. 2010;41(9):1969. Epub 2010 Jul 29.
- Incidence and risk factors for the growth of unruptured cerebral aneurysms: observation using serial computerized tomography angiography. Matsubara S, Hadeishi H, Suzuki A, et al. ;J Neurosurg 2004; 101:908.
- Intracranial aneurysm enlargement on serial magnetic resonance angiography: frequency and risk factors. Burns JD, Huston J 3rd, Layton KF, et al. Stroke 2009; 40:406.
- Natural history of asymptomatic unruptured cerebral aneurysms evaluated at CT angiography: growth and rupture incidence and correlation with epidemiologic risk factors. Radiology 2013; 269:258. Villablanca JP, Duckwiler GR, Jahan R, et al.
- Unruptured intracranial aneurysms: natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet 2003; 362:103. Wiebers DO, Whisnant JP, Huston J 3rd, et al. ;
- Hospital mortality and complications of electively clipped or coiled unruptured intracranial aneurysm. Stroke 2010; 41:1471. Alshekhlee A, Mehta S, Edgell RC, et al. ;

Autor:

dr n. med. Arkadiusz Kacała
Asystent w Zakładzie Radiologii Ogólnej, Zabiegowej i Neuroradiologii Uniwersyteckiego Szpitala Klinicznego we Wrocławiu, oraz w Katedrze Radiologii Uniwersytetu Medycznego we Wrocławiu.
Specjalizuje się w zabiegach wewnątrznaczyniowych w obrębie ośrodkowego układu nerwowego oraz w zakresie naczyń obwodowych.
Baza wiedzy
- Aktualności (2)
- Baza wiedzy (460)
- Alergia (23)
- Antykoncepcja (51)
- Choroby autoimmunologiczne (17)
- Choroby kości, stawów i mięśni (51)
- Osteoporoza (8)
- Choroby krwi (29)
- Choroby naczyń (17)
- Choroby noworodków i wieku dziecięcego (48)
- Choroby przewodu pokarmowego (9)
- Choroby reumatyczne (18)
- Choroby skóry (2)
- Choroby układu nerwowego (23)
- Choroby układu oddechowego (48)
- Ciąża (81)
- Karmienie piersią (10)
- Niepłodność (5)
- Poród (33)
- Dieta i witaminy (15)
- Kobiece sprawy (123)
- Choroby narządów płciowych (17)
- Cykl miesiączkowy (6)
- Endometrioza (3)
- Mięśniaki macicy (3)
- Piersi (3)
- Leki (11)
- Nowotwory (48)
- Rak jajnika (4)
- Rak piersi (9)
- Rak szyjki macicy (4)
- Rak trzonu macicy (2)
- Recepta online (1)
- e-Recepta (1)
- Suplementy (10)
- Zaburzenia gospodarki węglowodanowej (3)
- Bez Kategorii (6)
- Poradnik (14)

1. Wybierz i kup konsultację
2. Skontaktuj się ze specjalistą